谷之风 谷之风好消息 | 西安立迪动物设施通过国际AAALAC复审认证!来源:发布时间:2017-04-11 10:14 去年10月 上海立迪生物技术股份有限公司 在北京全国中小企业股份转让系统 (NEEQ,简称“新三板”) 成功挂牌 标志着立迪生物发展跨入新时代
最近,立迪生物又传来好消息 上海立迪上海、西安两地 动物设施均通过AAALAC复审认证
AAALAC到底是什么呢? 我来给大家科普一下吧~
AAALAC认证
国际实验动物管理评估及认证协会(AAALAC,Association for Assessment and Accreditation of Laboratory Animal Care International)是世界公认的国际认证机构之一,AAALAC认证是我国新药安全评价和科学研究走向国际的一个重要环节,成为我国生命科学事业与实验动物福利、伦理与国际接轨的重要标志。我国动物实验平台通过AAALAC认证的瓶颈在于兽医(Vet)培训,动物伦理委员会(IACUC)和环境健康安全(EHS)等问题。
2017年3月29日,国际实验动物评估和认可委员会AAALAC(Association for Assessment and Accreditation of Laboratory Animal Care)发来正式通知,上海立迪生物技术股份有限公司(Shanghai LIDE Biotech)以及子公司西安立迪生物技术有限公司(Xi’an LIDE Biotech)动物设施均通过国际实验动物组织的复审,认证持续生效。
上海立迪生物技术股份有限公司及子公司西安立迪生物技术有限公司动物设施均于2014年首次通过AAALAC认证。西安立迪生物技术有限公司更是整个西北地区首个通过AAALAC认证的设施。根据AAALAC组织认证规程,所有通过认证的设施须每3年接受一次复检。其中,首次复检尤其严格。
通过2016年度的评审,专家组对上海立迪生物技术股份有限公司及子公司西安立迪生物技术有限公司实验动物从业人员高品质的实验操作及动物护理能力、规范动物饲养与使用、尊重动物福利与伦理、规范的管理制度、设施的合理设计、仪器的良好维护等工作给予了充分肯定,并对改善实验动物饲养和使用的相关工作提供了宝贵的建议。
本次复审的顺利通过保持和巩固了上海立迪生物技术股份有限公司及子公司西安立迪生物技术有限公司在实验动物相关工作中的优势地位,对于自身实验动物和动物实验管理水平的提高,对科研、生物医药等方面提供高品质实验动物和优质技术服务等都具有重大意义。
立迪:PDX让肿瘤治疗进入“私人定制”时代
2012年,西安高新区与西安立迪生物技术有限公司共同建设了“西安高新区转化医学公共技术平台”,该平台致力于肿瘤个体化精准医疗研究、服务及产品开发。2014年,平台的实验动物中心获得了陕西省唯一的AAALAC国际认证。
下面小智分享一篇由贝壳说邀请立迪执行总裁闻丹忆主讲的——人源化移植瘤模型(PDX)的转化医学应用的报告。
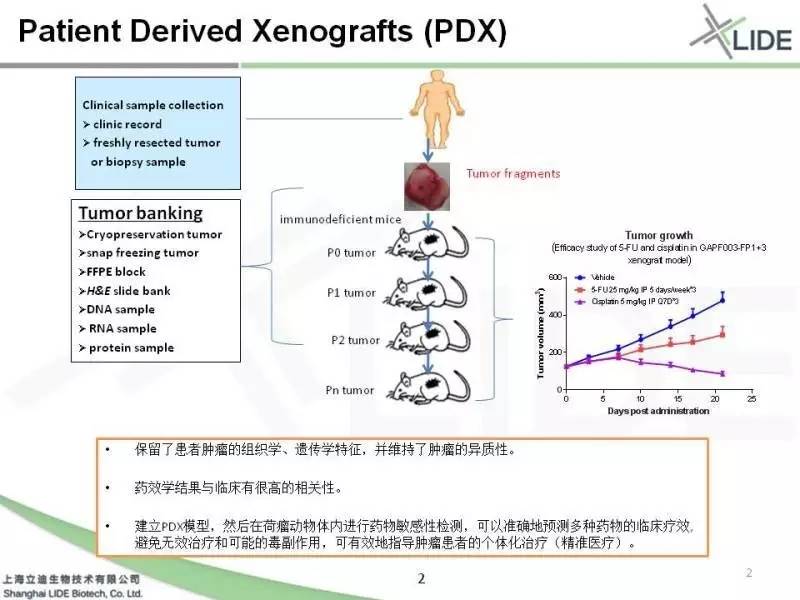
PDX是手术病人的样本切下来以后,接种在免疫缺陷的小鼠体内,在小鼠身上成瘤以后可以进一步传代。建成的这个模型保留了这个肿瘤患者的组织型和遗传学的特征,并且维持了肿瘤的异质性。这种模型跟临床的药效学结果有极高的相关性,所以它们被广泛的应用到药物研发当中。
PDX解决了临床前及临床应用的两个痛点
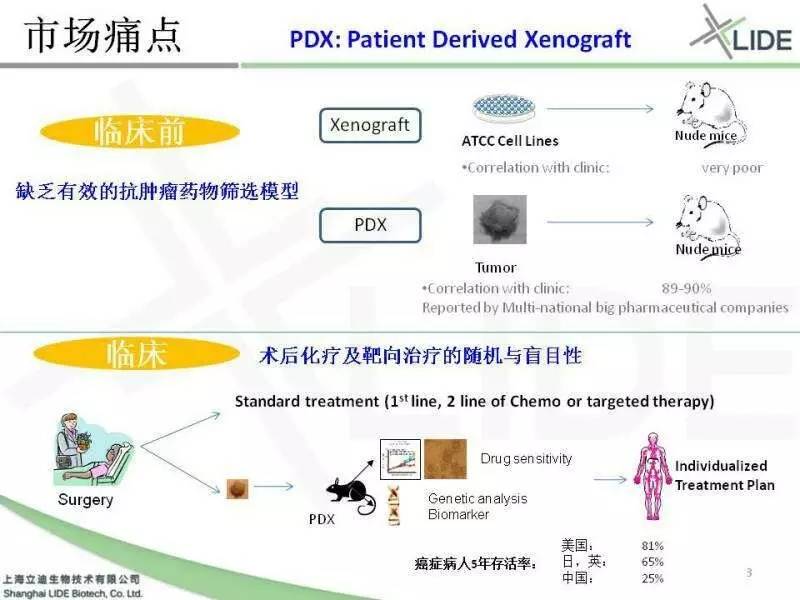
这个模型解决了市场上的两个痛点,一个是在临床前的应用,一个是在临床的应用。
临床前传统意义上筛药都是用ATCC的细胞系打在老鼠皮下,我们称为Xenograft model。后来经过多年的应用,大家发现这种模型跟临床的相关性不到5%。所以大约20年前的时候德国人开始用肿瘤样本,直接接种在老鼠的皮下,建成PDX模型。后来经过10- 20年的验证,大家发现这种模型跟临床的相关性可以高达89%到90%,所以全球的药厂现在都在使用这种模型进行药物的筛选。
它解决的第二个市场痛点,手术以后化疗和靶向药治疗存在着很多的随机性与盲目性。往往一线药指南用过之后,在二三线药之后的选择具有很大的随机性。在这种情况下,因为PDX模型跟临床相关性较高,所以国外开始尝试使用这种模型,通过药效结果指导临床的用药。经过这些年的发展,国外很多大的医院都在半商业半科研的形式在推广PDX模型的临床应用。
根据统计,世界各国癌症病人五年存活率,美国可以高达81%,日本、英国有65%,但是在中国只有25%。其实国内的治疗手段及医疗器械,并不逊于国外,但是我们的五年存活率为什么这么低。因为很多可以应用到临床的精准医疗手段,并没有得到有效的利用。今天和大家分享一下,如何利用PDX模型在转化医学当中指导精准的用药。
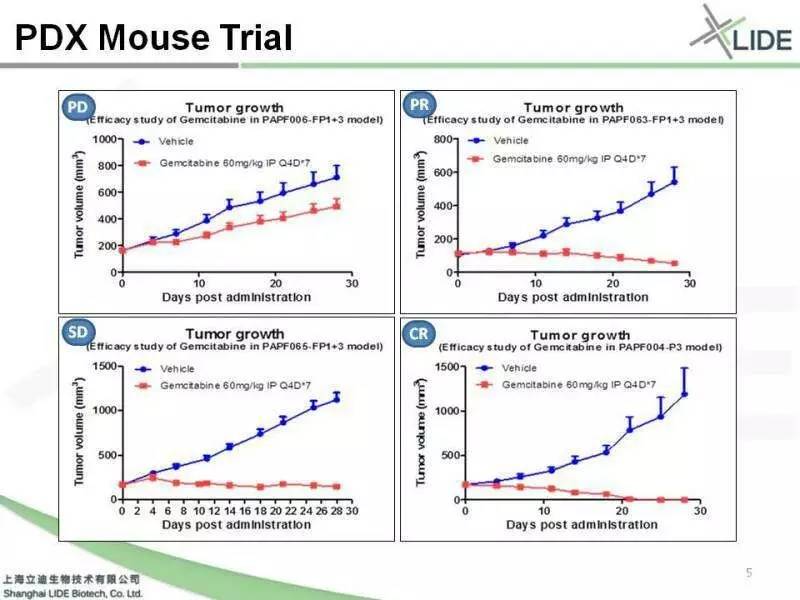
PDX在临床前的应用,很大一部分来进行Mouse Trial,clinic trial on mouse。比如说这些病人都是胰腺癌的患者,肿瘤样本切下来以后建成的PDX,统一用首选药健择进行治疗。在做药效的过程当中,发现PDX的药效反应与临床非常接近,它有四种不同的状态,包括progressive disease(疾病进展)、stable disease(疾病稳定)、partial remission(部分缓解)、complete remmison(完全缓解)。
同样的治疗,同样的方法为什么会有这样不同的结果?其实是由每个人的基因类型所决定的。比如说有100个胰腺癌患者的样本建成的PDX,每个模型代表一个病人,那么药厂在进行MouseTrial的时候,通过在PDX模型上的药效筛选,就会分出两组反应完全不同的 PDX.,一组 Non-Reposnder (PR).完全无效;另一组Responder (CR) 非常有效.。然后这样两组的PDX都去进行基因组的测序,再经过生物信息的分析找出所谓的病人的StratificationMarker (分选信号),这个也就是大家往往在药物研发当中经常需要寻找的伴随诊断。
伴随诊断的概念其实是很早就提了,在2011年的7月的时候,FDA首先发布了一个新的指导方针,鼓励大家来做这种伴随诊断的生物标记来指导临床精准的药物研发。Genentech Zelboraf是治疗黑色素瘤的药。2011年FDA在批这个药的时候,有史以来第一次带了一个伴随诊断的标记,就是cobas 4800 BRAF V600 Mutation。换句话说如果病人诊断了黑色素瘤首先必须进行这样一个检测,看他是不是有这样的一个突变,只有BRAF这样的一个突变才适合用这个药。两个星期以后FDA又推了一个辉瑞的治疗非小细胞肺癌的药,叫做克唑替尼,其实这个药也是经常在演讲中会当作一个故事来讲。
这个药第一次在做临床实验的时候只有0.6%的反应率,所以这肯定是一个失败的药。后来他们通过研究,日本人发了一个文章,发现这个药其实跟EMK4-ALK的融合基因有关。那么辉瑞利用这样一个信息来事先筛病人,只有有这种融合基因病人才再入组临床实验。结果做了两个临床实验,一个50%有效,一个60%有效。所以FDA给了一个快速批准,所以大家可以看到,像这样一个药如果没有伴随诊断的标记,这个药根本就不能成为药。
目前这个药在中国批了,用于治疗非小细胞肺癌。所以临床前做MouseTrial,基本上就是这样一个套路,希望通过PDX 中的有响应组及无响应组的生物信息学分析,找出 Gene Signature, 做为伴随诊断的生物标记物。
PDX在临床前的另一个用途,是寻找新的Indicaiton.比如说有某个靶向药按乳腺癌获批了,相同的基因类型在胃癌或非小细胞肺癌中也有表达,是否这类药可开发成治疗胃癌或非小细胞肺癌的药物呢? 。如果按照经典的方法来做系统的人体临床实验,肯定是非常高的费用,所以大家往往在这种情况下也会用PDX药效来初步验证“老药新用”的设想,大大降低的药物研发的费用。
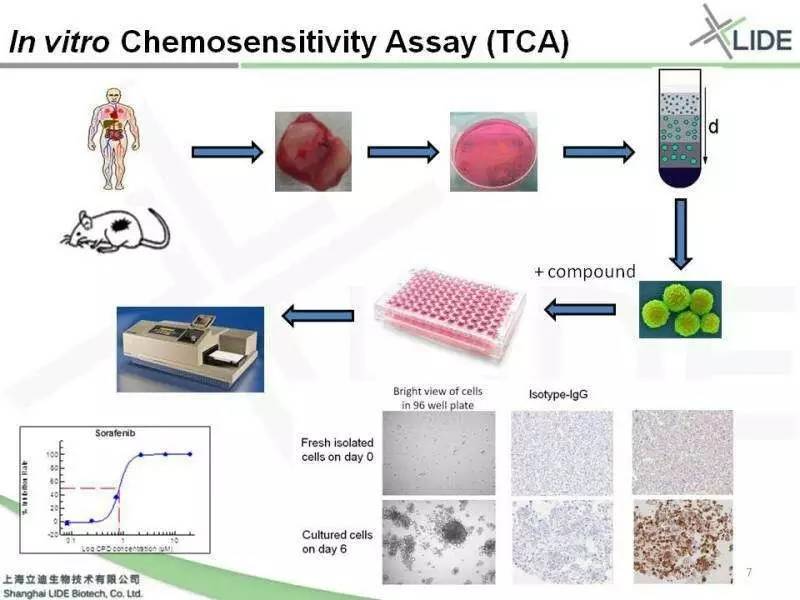
PDX必定是在老鼠身上的实验,时间周期比较长,所以在很多情况下还是需要在细胞水平进行第一轮的筛选,但ATCC的细胞系,跟临床的临床的相关性非常低。所以大家就在尝试用PDX分离的原代细胞做体外的药理实验。这种体外的 Ex vivo 检测与体内药效学结果相关性比较好,所以现在也是很常用的一个药物筛选的套路。
另外为了更进一步的从细胞的水平进行更进一步的研究,往往也是要建一些PDC,就是patientderived cell line,如果直接从病人的样本建细胞系,往往成功率相对比较低。病人手术样本取下的瘤块实际上是有很大的异质性,它即有肿瘤细胞,同时也包含很多的间质细胞,Stroma cell。如果是能够在老鼠体内先建模,再进行体外培养,建 PDC就相对更容易。所以我们也是做了一些尝试,发了一个PLOS的论文,这里头看到,我们先建成的PDX,我们再过来建它对应的细胞系。建成的细胞系,要进一步进行系统的鉴定,包括免疫组化的鉴定,染色体的鉴定,STR的分析等等,然后也要检测它细胞的细胞周期、药效学并进行病理染色。
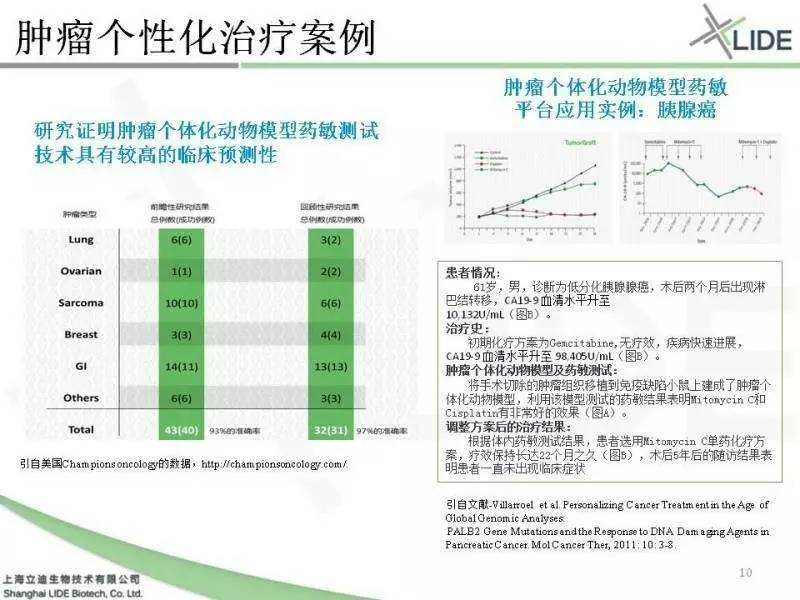
因为PDX模型跟临床的相关性非常高,所以国外也开始尝试用它进行临床的应用。一个胰腺癌的患者,术后出现淋巴结转移,CA199是一万多。用了首选药健择以后没有效果,疾病迅速进展,CA199涨到了九万多。这时候他的PDX模型的药效结果显示,非常普通的一个药,丝裂霉素对他非常有效。结果医生更改治疗方案,发现整个疗效长达22月之久,术后五年都没有出现症状。
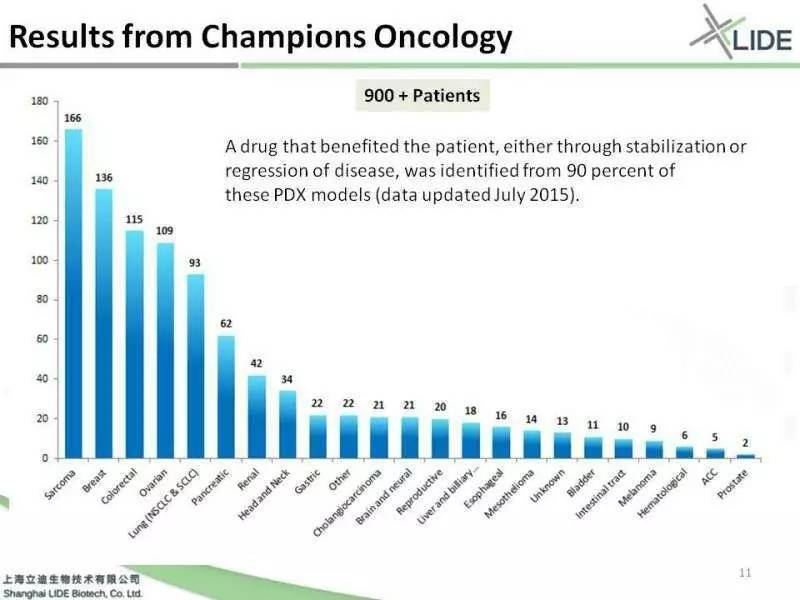
美国专门做PDX临床应用的公司有一家公司叫Champions,它也是一个上市公司,他们也做了很多系统的验证的工作,所以在去年的AACR会议上他们也报道,跟SanofiAventis做过这种前瞻性的临床实验,同时也跟很多的医院的 Leading PI,进行一些验证的工作。所以这张图表呢是他们在去年AACR会上的报道,已经做了将近900多个病人,它的相关性仍然是高达90%。换句话说,只要在老鼠身上有效,用到病人的时候都是90%都是临床有效。
我们进一步把这个PDX应用到临床上,其实它是可以把它分解成这样一个平台,三个产品,它的优势是可以满足临床不同层次的病人的需求,肿瘤患者诊断了有肿瘤以后,他需要手术的时候,首先建议他留种,所谓的留种就是把样本新鲜的接种在免疫缺陷的老鼠身上,长起来以后用特殊的方法再把它冻存。那这个从另一个角度来讲也是生物样本活库,因为大家一般情况下在做样本库都是直接冻存一块组织。那么这些组织的话其实只能说将来提了RNA、DNA做一个研究,可能得到一个统计的意义,它并不能传代。而这个留种的PDX它其实是可以传代的。
如果病人是一个胰腺癌的患者,一线用药选择就很简单,因为首选药国家就批了一个药,健择,可是如果病人得的是消化道肿瘤,或者是妇科肿瘤,医生就面临很多的选择问题。比如说胃癌在NCCN指南里,胃癌的首选药就有九个,从某种意义上来讲,医生用哪个都不是错的。所以医生可以根据他的经验,往往都要通过病人来进行试。试了以后如果药效不敏感,医生就再来给他换药,而这个当中,往往在这个药对病人不敏感的时候,对病人的伤害也是很大的。
那么在这种情况下我们就会有一个叫miniPDX的产品,它通过两周出结果,帮助医生一线用药做一个排序。而肿瘤病人治疗中的最大难题是肿瘤的复发转移,手术切下的肿瘤样本中有一份特殊的,有肿瘤干细胞特征的一部分群体,而这部分群体在老鼠体内是差异性的得到了扩增。所以在老鼠体内长成的PDX,它其实长出的群体是有肿瘤干细胞特征的肿瘤群体,所以它的药效结果是对应于复发转移耐药病人以后的药效的选择,而跟你一线药的选择实际上是不一样的。换句话说,如果是肿瘤病人的样本直接拿来做药效,在老鼠体内长成PDX再做药效这两个结果是不一样的。
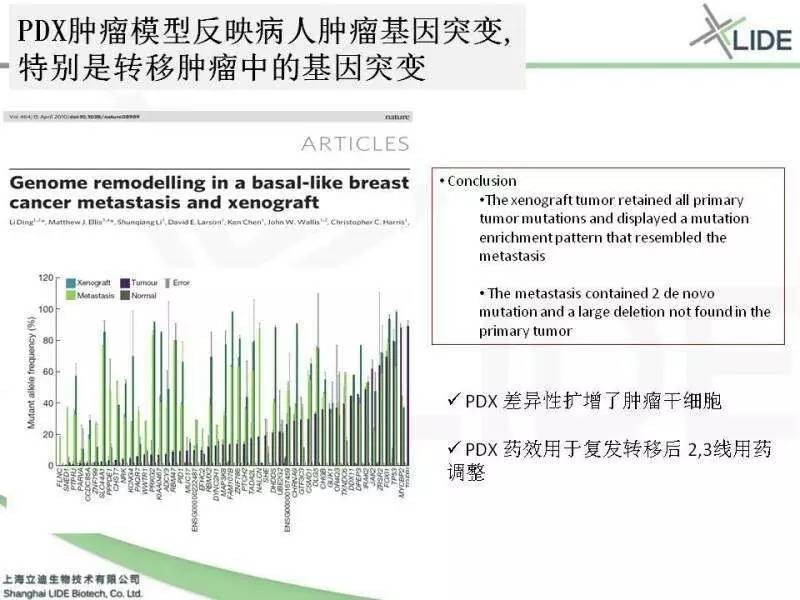
一个乳腺癌的患者,手术以后肿瘤样本拿下来直接进行了测序。同时有一部分样本打在老鼠体内,成功的建成了PDX模型,在这个图表上显示的就是湖蓝的这组样本。病人后来又复发转移到脑,就把转移到脑的转移灶取下来以后,进一步的也拿这个样本进一步测序。所以你看到这个图表里头,肿瘤的原发灶的样本是紫色的,PDX的样本是湖蓝的,而这个转移灶是绿色的。从图表中不难看出,PDX模型和复发转移灶的图谱是重叠的。也就是说PDX差异的扩增了肿瘤干细胞,所以在PDX做出的药效是用于复发转移以后二三线用药选择的,在今年AACR会上我们跟药厂也有交流,听说药厂做到的也是一样的结果。当然他们那个做的实际上是一个肠癌的,有 KRAS突变,药厂的发现跟《自然》发布的论文是同样的结果。而我们自己的案例也证明了同样的结论。
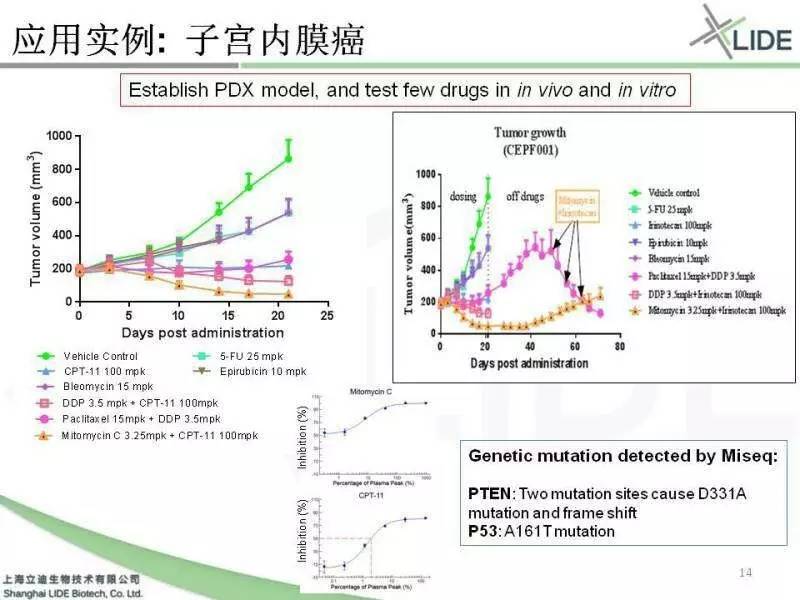
手术以后我们把她的样本建成了PDX模型,根据医生的建议我们实际上进行了不同药效检测,发现她临床用的药是白蛋白紫杉醇是粉色的,能够把它控制住,但是并不是最好的。但是我们找到一个组合是丝裂霉素加伊立替康对这个病人的效果就非常好。我们在实验三周以后就模拟临床的复发转移情形,停止用药。停药以后我们就看到紫杉醇这组就复发了,复发以后从两百立方毫米长到六百立方毫米。这时候我们用第一次药效结果找到的丝裂霉素加伊立替康用到这个模型上以后,整个肿瘤抑制下来又消失了。肿瘤样本在老鼠体内,是在压力性生长,有肿瘤干细胞特征的这部分的群体得到了扩增。所以在PDX上做出的药效它对应的是病人复发转移以后的药效的结果,而对于这个特定的病人我们用我们刚才介绍的方法,我们也做了体外三维的TCA的结果。所以你们看到我们体外的结果跟体的相关性还是非常好的。
这个病人第一次手术以后我们把样本取下来,建了一个PDX。后来他肠癌肝转移,中山医院的院长做了手术以后把样本也给到我们,所以我们把第二次的样本也做了PDX。然后两次的结果拿去测序,发现转移灶的PDX与原发灶的相比,其实是有C-MET扩增。那这时候这个病人也是要进行化疗和靶向药的治疗。根据医生选择的话,我们就进行了大约十种药的PDX药效检测。最终查到的结果是阿瓦斯汀加伊立替康对病人的效果非常好,后来这个病人在春节前不幸又复发了,复发以后这时候医生就用到我们所选的阿瓦斯汀加伊立替康治疗以后,病人就反应非常好,CT影像显示她的多发出的转移灶都有所改善,而且CA199又回到了稳定的水平。
所以对于这个病人来讲,她是很幸运的,在目前阶段仍然是稳定状态。但是大家知道在这个阶段我们已经把所有临床批了的药都测试过了,如果下次再复发转移的时候,已经批了的药对他就没有效了。我们刚才讲到,图的左边显示,我们因为知道复发灶实际上有C-MET的扩增,所以我们找了临床正在在研的药进行检测。我们找到了药厂正在研究当中的C-MET和VEGF的这样一个抑制剂,然后直接用到这个瘤身上,发现对这个实际上非常敏感。这个实际上给我们两个信息,在中国的话我们只能告诉病人,就说你如果在复发转移,可能争取入组到正在做临床实验研究的这样一个实验当中,但是在国外,其实在FDA的网站有这样一个表格,叫做《IndividualR&D》,就说已经批了的药你都无效以后,这时候你做出来的PDX结果,如果显示对这个临床在研的药有效,病人其实可以自愿参与IndividualR&D,来使用这个尚未获批的药,某些国外的药厂甚至免费提供药品。
这是第一个信息,可以告诉病人有哪些在研的药有可能能用。第二个信息大家可能也还记得,刚才我介绍辉瑞的那个治疗非小细胞肺癌的药,那个药虽然它是有一个生物标记,叫做ALK融合基因这样一个标记,但是那个生物标记实际上是歪打正着后来找着的,而那个药的本身其实是C-MET的抑制剂。换句话说,这个病人虽然是肠癌,但是她在二三线药如果无效以后,可以尝试用我们国家批了的治疗非小细胞肺癌的这个克唑替尼来进行治疗。
刚才介绍的这样一个例子也是临床能够超说明书用药的案例,否则的话也不能说肠癌的病人治疗其他药都没有效了,那我们就拿一个肺癌的药试试,事实上是有依据的。另一个概念呢现在国外也是进行比较多的,叫做BasketTrial,它往往是根据基因类型来入主临床实验。所以入主实验的病人是各种的肿瘤,可以是肠癌,也可以是肺癌,也可以是头颈部的肿瘤,但是假如说他们都有一个共同的特点,比如说C-MET的扩增,那么这些病人都可以用C-MET的抑制剂,所谓的这样一个异病同治这样一个概念。而做这种治疗的前提其实是要对应的做这样的基因的检测。
循环肿瘤细胞我们实际上是因为PDX的模型的研究,我们跟梅奥诊所有合作,三年前去Mayo Clinic参观的时候,通过他们的介绍我们引进了微流控的平台。通过微流控的技术能够把循环肿瘤细胞进行富集,这个可能是目前在已经有的技术当中唯一的能够把循环肿瘤细胞完全以活的形式来分离出来的技术,所以分离的出细胞是在管子里,可以进行细胞的培养,也可以做各种的下游的检测,二代测序,PCR,同时也可以在体外培养。微流控的平台能够分出活的细胞,所以虽然有很大的优越性,但它也有很大的局限性,就是它处理一个样本大约需要一个小时的时间,所以大量临床的样本检测肯定是不合适。
所以我们综合评估以后,我们又引进了膜过滤的平台,就是现在虽然有很多膜过滤的方法在分离这个CTC,而我们引进的这个平台它是唯一采用德国进口透明的膜过滤技术。其实,膜过滤只是一个前处理步骤,处理以后它实际上是一个细胞病理的检测,我们就可以进行形态学的染色,细胞病理的医生可以通过形态来进行判断是否有循环肿瘤细胞。更进一步为了确认肿瘤细胞的存在,我们也可以用免疫荧光的其他的检测。
这种透明的膜检测的方法,实际上是它既结合了形态学的判断,同时又结合了免疫荧光的染色,所以假阳性率就相应比较低。有一些其他的技术,如果它的这个膜不透明的话,它其实是不能做形态学的判断,这样它就只能用一种标记来染色。比如说用CK来染色,CK是一个上皮的标记,那用CK染色以后病理医生只能出报告,说我查到上皮来源细胞,或者是说我用叶酸标记来染色,那也只能报我查到叶酸升高细胞。但不管是上皮来源细胞还是叶酸来源细胞,它都有可能是循环肿瘤细胞,也有可能是过敏或者是炎症,所以这种的检测方法相对就会有一些假阳性。
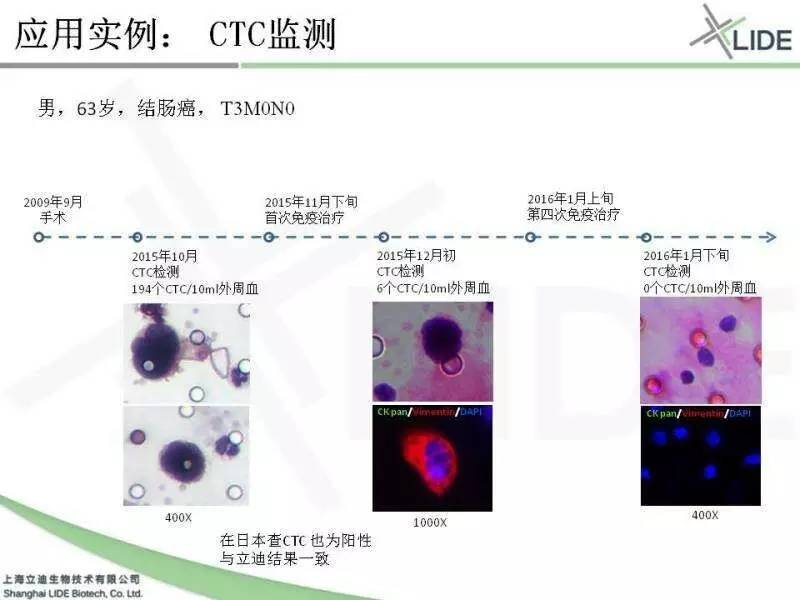
这个病人是肠癌的患者,在09年就做的手术,术后基本上是稳定的。后来我们因为引进了循环肿瘤细胞技术,他到我们这边来检测,用微流控技术和用膜过滤的的技术,我们都发现他的循环血里头有很多的循环肿瘤细胞。但是他到北京另外一家机构检测的时候就没有查到。所以他自己也比较迷惑,就是他到底有没有这个循环肿瘤细胞。后来他就到日本去做了体检,在日本体检并没有发现有明显的复发转移灶。换句话说,就是他虽然在外周血里检测到有循环肿瘤细胞,但是并没有出现成复发转移灶。这时候病人比较怀疑到底有没有CTC。
后来,他在日本做了个CTC检测,结果与我们的报告是一致的:换句话说这个病人虽然并没有出现复发灶,但是他的确血中有循环肿瘤细胞。这时候他就决定去做细胞治疗,实际上是通过深圳源正进行了细胞治疗,两个疗程以后他外周血的CTC从194个就变成了6个。循环肿瘤细胞有往间质转变的特征,所以它如果转移到间质的时候,往往就容易落成复发转移灶。这个病人虽然最后从194个降到了6个,但是这6个细胞中,仍然有这种相应的有往间质转变的细胞群体,所以他进一步进行了继续的免疫治疗。到四个疗程以后,他的免疫循环肿瘤细胞再来查的时候就已经没有了。所以这样一个例子就说明,循环肿瘤细胞在手术以后,它其实是一个很好的高级生物标志,通过术后定期监查CTC,帮助医生及时掌握的治疗时机
刚才介绍的我们第一个CTC的检测平台其实是微流控的。那么微流控的技术有一个比较好的特点,它分出来的细胞是活的。所以我们与胸科医院的陆舜主任合作,采集了一些特殊病人的样本。这些病人的肿瘤驱动基因是阳性的。使用靶向药以后病人就出现了耐药,耐药以后病人外周血,胸腹水都有很多的循环肿瘤细胞。所以我们通过微流控的技术富集CTC,然后我们也成功的注射在老鼠体内,建成CTCderived xenograft model (CDX)。病人的样本直接测序,发现它有L858R的突变,或者是有ALK这个融合基因。但是它复发转移以后出现的这个CTCderived xenograft我们再去进行测序,发现了它有新的突变。
比如说第一个模型除了L858R突变以外呢,又有了EGFR扩增。第二个模型实际上仍然有ALK的融合基因。而第三个就是CTC15063这个病人除了L858R的突变,就出现了T790的突变。而对于第三个模型我们回去找到他临床信息,耐药之前他用的是厄洛替尼,以后产生了耐药,然后我们用他的CTC建成了CTC derived xenograft发现他有T790M的突变,然后我们就找来了AZ的新的药,专门对应T790M的,叫做9291,检测结果显示:我们的结果跟临床是完全吻合的。大家看到这个图表的左边就是厄洛替尼,所以这个病人对厄洛替尼已经产生耐药,没有效果,但是我们用9291他就很敏感。那么现在虽然9291在中国还没有批,但是很多病人已经在吃这些原料药,所以中国的病人已经发现有9291耐药的了。我们现在也正在建9291耐药的模型。
现在再跟大家简单介绍一下我们公司。我们公司是2011年底成立的,然后我们跟很多医院有正式的合作。我们承担的第一个项目是由协和医院赵院长牵头的这样一个,由十家医院参加的国务院的专项的生物样本活库项目。在这个项目当中样本的采集和冻存的传统意义上的这些死库,是由各家医院来完成的,而配对的活库是由我们立迪来完成的,这样通过这个跟很多医院建立官方的合作。
然后在2012年4月的时候我们又进一步的成立了子公司,叫西安立迪,这个是跟西安高新区合作。
我们天使轮的投资是在2013年的4月由泰格医药进行投的。因为我们目标就是希望能够做到转化医学的临床应用。所以我们又进一步成立了一个子公司,叫做上海立闻。那么经过两年的努力,我们上海立闻拿到了临检所的资质。所以从公司的架构来讲我们上海立迪下边有两家子公司,一个是西安立迪,一个是上海立闻。立迪是定为服务药厂的临床前的CRO,而立闻实际上是面对病人的独立第三方检验的临检所。所以我们虽然在两边都不是唯一的,但是做这种转化医学的项目,我们把两边串起来,所以我们的市场定位是比较独特唯一的。
现在精准医疗大家也都说的非常热,但是很多情况下往往把精准医疗就认定成基因突变的分析,这个虽然是很重要的方面,但是它并不代表精准医疗的全部。所以我们有时候考虑问题也是要把复杂的问题简单化。我们如果说用基因测序检测它的突变,能够解决25%的病人能够靶向用药的问题,那么另外的75%的病人怎么办呢?我们其实是希望能够解决另外75%的病人精准用药问题。所以我们注册的产品叫做安可维系列。这个包括刚才介绍的用老鼠身上的PDX的药效,包括MiniPDX,包括三维细胞球、类器官,和三维的TCA。所以我们的产品也是希望能够给个性化的精准治疗提供一站式的服务平台,这里头包括有手术的病人,如果手术的时候可以帮他做PDX的药敏,也可以做体外的三维的TCA。然后也可以做分子病理的检测,同时液体活检的技术,循环肿瘤细胞,循环DNA,microRNA等等的这些检测。所以是通过这样一个综合的手段,希望能够帮助到临床指导临床的医生能够精准的选择精准病人的精准用药。
所以总结起来我们希望为肿瘤患者提供全程管理的服务。比如说在早期筛查,像现在尤其像肺癌,由于低螺旋CT的检测,很多病人就发现了小结节,但是这些结节到底是不是肿瘤,可能里头有很大一部分只是炎症或者钙化点。所以如果结合循环肿瘤细胞的检测也能够帮助判断它到底是不是肿瘤。另外如果病人开始需要手术的时候,我们可以建议他留种。那么一线药需要做选择排序的时候,我们可以用两周出结果的Mini的PDX。后面复发转移的时候我们可以用常规的PDX。然后同时监测它的复发转移呢,我们又可以有循环肿瘤细胞。所以我们的这些产品实际上是贯穿着肿瘤患者的这个全程的管理的过程。
|